¿Qué es la caquexia?
Proveniente del griego καχεξία [kachexía] o “mala constitución”, la caquexia es el término que describe un estado fisiológico caracterizado por desnutrición, pérdida o atrofia de masa muscular, y debilidad. La caquexia se considera una pérdida involuntaria de peso corporal como consecuencia de una patología subyacente, en la que se incluyen la insuficiencia cardíaca, la enfermedad pulmonar obstructiva crónica (EPOC), la enfermedad renal crónica, el SIDA o el cáncer. En relación a la última, la prevalencia de la caquexia es de aproximadamente el 80% en los pacientes con cáncer y es responsable de alrededor del 20% de las muertes provocadas por dicha enfermedad.
La caquexia es, por tanto, una comorbilidad grave que causa fatiga, disminución en la calidad de vida e independencia funcional, así como reducción de la esperanza de vida. Es este motivo por el cual diseñar una estrategia terapéutica contra la caquexia inducida por cáncer es clave a la hora de favorecer la salud física y mental de los pacientes, su capacidad de respuesta tanto a la quimioterapia como a la radioterapia, y su supervivencia.
Del tumor a la caquexia
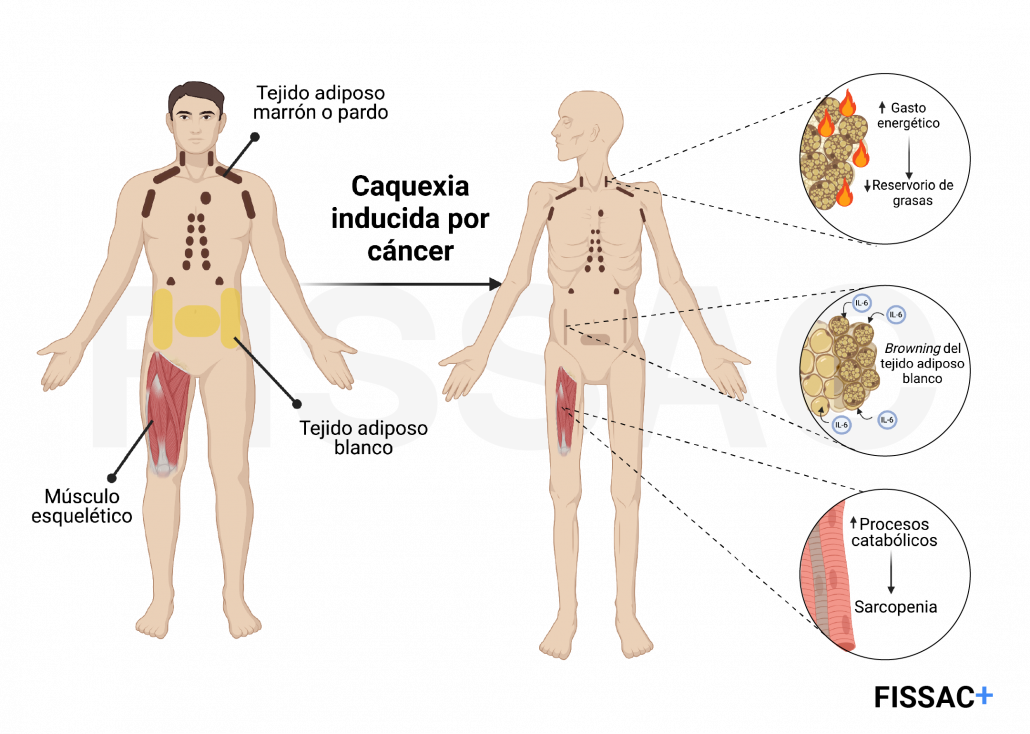
Durante el desarrollo de la caquexia, la reducción de la masa que constituyen tejidos altamente metabólicos, como el tejido adiposo blanco y el músculo esquelético, es la responsable de la pérdida de peso corporal. Esto es debido a alteraciones relacionadas con el metabolismo de carbohidratos, lípidos y proteínas, motivo por el cual se considera la caquexia como un síndrome metabólico.
Se ha observado que parte de la pérdida de masa muscular (proceso conocido como sarcopenia) durante la caquexia inducida por cáncer está asociada al propio metabolismo de las células tumorales, caracterizado por un incremento en el metabolismo glicolítico. De hecho, como consecuencia de dicho metabolismo característico de los tumores, se han descrito varias respuestas en las células musculares que resultan en sarcopenia, dentro de las cuales se incluyen: incremento en la actividad del catabolismo o de degradación de moléculas (1), y disfunción mitocondrial, así como consecuente deficiencia en la obtención de energía (2), entre otras.
Un ejemplo de cómo el metabolismo tumoral promueve un incremento en el catabolismo es el descrito por Karlstaedt y colaboradores (3). En su estudio, los autores identifican que el producto metabólico D-2-hidroxiglutarato (D2-HG, característico de las células cancerosas) actúa en el músculo esquelético activando la vía catabólica conocida como autofagia. El término “autofagia” nace de la idea de “comerse a uno mismo”, dado que la función de este proceso celular es la degradación de componentes propios de las células, lo cual permite su reutilización. La autofagia es esencial y está estrictamente controlada en todos nuestros tejidos, ya que se estimula en condiciones de estrés, como la falta de nutrientes, para garantizar la supervivencia celular. Por ello, alteraciones en la actividad autofágica han sido relacionadas con diversas patologías, incluyendo la sarcopenia y la atrofia muscular. En este caso, se ha observado una sobreactividad autofágica en músculos caquécticos tanto en humanos como en roedores (4,5). Por lo tanto, la generación de un tumor cuyo metabolismo estimula vías catabólicas, como la autofagia, en el músculo esquelético resulta en la disminución de la masa muscular característica de la caquexia.
Otro proceso clave promovido por las células cancerosas en el desarrollo de la caquexia es la inflamación sistémica. Diversos estudios han descrito que la implicación de citocinas inflamatorias secretadas por tumores, como la interleucina 6 (IL-6) (6), TNFα (del inglés, Tumor Necrosis Factor alpha) (7) o TGFβ (del inglés, Transforming Growth Factor beta) (8) es la responsable de la activación de los procesos caquécticos en tejidos altamente metabólicos.
De hecho, concretamente la acción de IL-6 secretada por tumores promueve tanto la pérdida de tejido adiposo blanco como de músculo esquelético. En el caso de su efecto en el tejido adiposo blanco, la pérdida de este tejido durante la caquexia se debe, en parte, a su conversión a tejido adiposo pardo o marrón. Este proceso se conoce como “pardeamiento” o “browning” del tejido adiposo blanco, el cual es iniciado por diversos factores, incluyendo la acción de IL-6 (9). La producción y secreción de IL-6 por los tumores promueve un incremento en los niveles de termogenina (también conocida como UCP1, del inglés, Uncoupling Protein 1) en las células del tejido adiposo blanco o adipocitos blancos. La termogenina es una proteína mitocondrial característica de los adipocitos pardos cuya función es la de promover la generación de calor no asociado a temblor, es decir, la termogénesis. De hecho, la termogénesis es un proceso biológico del cual se encarga el tejido adiposo pardo y que comporta un gran gasto energético. Por lo tanto, el aumento en los niveles de termogenina estimulado por la inflamación sistémica asociada a tumor promueve un cambio en la fisiología del tejido adiposo blanco, convirtiéndolo en tejido adiposo pardo, lo cual comporta dos eventos clave en el desarrollo de la caquexia: i) la disminución del reservorio corporal de grasas, y ii) un incremento significativo del gasto energético.
En resumen, cambios en la actividad de la autofagia en el músculo o el browning del tejido adiposo blanco son tan sólo dos de toda una plétora de vías estimuladas a nivel sistémico a consecuencia de la presencia de un tumor en el organismo. En un contexto tumoral, el resultado de la alteración de dichas vías es la caquexia, por lo que estimular una buena salud muscular, así como del resto de tejidos altamente metabólicos, en pacientes con cáncer puede resultar un enfoque favorable para la supervivencia a la enfermedad.
El ejercicio físico como terapia contra la caquexia inducida por cáncer
El impacto del ejercicio físico ha sido extensamente evaluado en el contexto de múltiples patologías en humanos(10). Sin embargo, según diversos meta-análisis (11, 12), hay una considerable falta de evidencia en relación al uso de la actividad física como tratamiento contra la caquexia inducida por cáncer en humanos. Afortunadamente, hay diversos estudios realizados en modelos animales que arrojan luz a este campo, algunos de los cuales incluso aportan información concretamente en el impacto del ejercicio físico en tejidos altamente metabólicos de roedores caquécticos.
Por un lado, los estudios que analizan los efectos de la actividad física en el músculo esquelético en el contexto de la caquexia se pueden diseccionar en función del tipo de entrenamiento aplicado en cada estudio. Para empezar, se ha demostrado que el ejercicio aeróbico en cinta de correr puede reducir el crecimiento tumoral, así como mejorar la masa muscular, en ratas con carcinosarcoma (13). Incluso el estudio realizado por Puppa y colaboradores describe que el ejercicio en cinta de correr en ratones caquécticos con cáncer colorrectal promueve una menor sarcopenia y pérdida de peso corporal, mejora la función mitocondrial en el músculo y atenúa la activación de vías catabólicas (14). Además, se ha demostrado que la hipertrofia inducida por contracciones excéntricas mediante electroestimulación en el mismo modelo murino también genera los mismos efectos (15, 16). En el caso del impacto del entrenamiento de intervalos de alta intensidad o HIIT, se ha observado que en un modelo murino de cáncer de mama con caquexia se puede prevenir la pérdida de masa muscular, presumiblemente mediante la disminución de la muerte de las células musculares (17).
Entre los efectos anti-caquécticos del ejercicio, las adaptaciones que se dan en el músculo esquelético se consideran centrales. Además, si la respuesta del tejido adiposo blanco al ejercicio en el contexto de caquexia es similar a la que se observa en el contexto de obesidad, se esperaría que la actividad física potenciara, en lugar de revertir, el efecto browning del tejido adiposo blanco, así como la disminución del reservorio corporal de grasas. Sin embargo, se ha documentado que la actividad física no sólo puede contrarrestar la caquexia mediante la mejora del estado metabólico global, sino también mediante la modulación de la inflamación sistémica (18), lo cual puede promover un efecto directo en las adaptaciones que sufre el tejido adiposo blanco durante el desarrollo de la caquexia.
De hecho, varios estudios describen que el entrenamiento de resistencia en ratas con carcinosarcoma estimula la producción de citocinas anti-inflamatorias, a la vez que reduce las pro-inflamatorias, lo cual favorece un ambiente anti-inflamatorio en torno al tejido adiposo blanco (19, 20, 21). En el caso de ratas con cáncer de mama entrenadas a largo plazo (durante 9 meses), se observa una reducción en los siguientes parámetros: i) cantidad de proteína C reactiva circulante, un clásico marcador de inflamación (22), ii) secreción de la citocina pro-inflamatoria TWEAK (23), iii) peso del tumor (19), y iv) aparición de lesiones malignas (22). Por lo tanto, dadas estas evidencias se puede especular que, a pesar de que el ejercicio físico modele el tejido adiposo blanco favoreciendo su reducción, se podría llegar a atenuar el efecto “browning” de la caquexia inducida por cáncer debido al impacto anti-inflamatorio que aporta la actividad física continuada.
Para disfrutar de todo el contenido únete a Fissac+
Sumérgete en la profundidad de Fissac y disfruta de todo lo que tenemos para ofrecerte. Suscríbete ahora y aprende con rigor científico con los audio-artículos, webinars, masterclass y Fissac Magazine
Para disfrutar de todo el contenido únete a Fissac+
Sumérgete en la profundidad de Fissac y disfruta de todo lo que tenemos para ofrecerte. Suscríbete ahora y aprende con rigor científico con los audio-artículos, webinars, masterclass y Fissac Magazine
En resumen, todos estos estudios, entre otros, apoyan la idea de que el ejercicio físico en sus diferentes modalidades – incluyendo el entrenamiento aeróbico y de resistencia, ejercicios de fuerza, y el HIIT – pueden ser beneficiosos en la prevención y tratamiento de los efectos de la caquexia en tejidos altamente metabólicos como el músculo y el tejido adiposo blanco. Por un lado, el efecto del ejercicio en músculos caquécticos previene la degradación de los componentes musculares y mejora la función mitocondrial, lo cual aporta un mejor estado metabólico – y, por tanto, salud – del músculo. Por otro lado, el impacto del entrenamiento de resistencia en la inflamación sistémica inducida por cáncer favorece la presencia de un ambiente anti-inflamatorio en torno al tejido adiposo blanco. Esto previene el efecto browning del mismo, lo cual resulta en el mantenimiento del reservorio de grasas y de peso corporal.
Conclusiones
Según la Sociedad Española de Oncología Médica, uno de cada dos hombres y una de cada tres mujeres tendrá al menos un tumor a lo largo de su vida. Dado que el 80% de lxs pacientes con cáncer desarrollan caquexia y ésta, a su vez, contribuye al 20% de las muertes por cáncer, es esencial el desarrollo de terapias poco invasivas para el tratamiento de la caquexia inducida por cáncer. Por ello, a falta de estudios científicos realizados en humanos, según los estudios preclínicos publicados durante la última década, el ejercicio físico puede considerarse la primera herramienta a la hora de intervenir esta comorbilidad grave. En cualquier caso, se conoce que “más vale prevenir que curar”, y considerando que hábitos tan característicos de la sociedad occidental, como el consumo de tabaco, la obesidad y el sedentarismo, incrementan significativamente el riesgo de desarrollar cáncer, la implementación de hábitos saludables desde edades tempranas también se puede considerar clave en la prevención de esta enfermedad y, obviamente, de la caquexia inducida por cáncer.
Referencias:
1. Amstrong VS., et al., Cancer-Associated muscle wasting – candidate mechanisms and molecular pathways. Int J Mol Sci, 2020. doi: 10.3390/ijms21239268.
2. Brown JL., et al., Mitochondrial degeneration precedes the development of muscle atrophy in progression of cancer cachexia in tumour-bearing mice. J Cachexia Sarcopenia Muscle, 2017. doi: 10.1002/jcsm.12232.
3. Karlstaedt A., et al., Oncometabolism drives autophagy activation in skeletal muscle. BioRxiv, 2020. doi.org/10.1101/2020.10.13.338202
4. Penna F., et al., Autophagic degradation contributes to muscle wasting in cancer cachexia. Am J Pathol., 2013. doi: 10.1016/j.ajpath.2012.12.023.
5. Aversa Z., et al. Autophagy is induced in the skeletal muscle of cachectic cancer patients. Scie Rep., 2016. doi: 10.1038/srep30340
6. Grivennikov S and Karin M. Autocrine IL-6 signaling: a key event in tumorigenesis?. Cancer Cell, 2008. doi: 10.1016/j.ccr.2007.12.020.
7. Szlosarek PW and Balkwill FR. Tumour necrosis factor alpha: a potential target for the therapy of solid tumours. Lancet Oncol, 2003. doi: 10.1016/s1470-2045(03)01196-3.
8. Massagué J. TGFβ in Cancer. Cell, 2012. doi: 10.1016/j.cell.2008.07.001
9. Li G. et al., Induction of uncoupling protein 1 by central interleukin-6 gene delivery is dependent on sympathetic innervation of brown adipose tissue and underlies one mechanism of body weight reduction in rat. Neuroscience, 2002. doi: 10.1016/s0306-4522(02)00447-5.
10. Pedersen BK and Saltin B. Exercise as medicine-evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sports, 2015. doi: 10.1111/sms.12581.
11. Grande AJ., et al., Exercise for cancer cachexia in adults. Cochrane Database Syst Rev., 2014. doi: 10.1002/14651858.CD010804.pub2.
12. Niels T., et al., Can Exercise Counteract Cancer Cachexia? A systematic Literature Review and Meta-Analysis. Integr Cancer Ther, 2020. doi: 10.1177/1534735420940414.
13. Deuster PA., et al., Endurance exercise modifies cachexia of tumor growth in rats. Med Sci Sports Exerc, 1985. Doi: 1985;17(3):385-92.
14. Puppa MJ., et al., The effect of exercise on IL-6-induced cachexia in the APC (Min/+) mouse. J Cachexia Sarcopenia Muscle, 2012. doi: 10.1007/s13539-011-0047-1.
15. Hardee JP., et al., Eccentric contraction-induced myofiber growth in tumor-bearing mice. J Appl Physiol, 2016. doi: 10.1152/japplphysiol.00416.2015.
16. Hardee JP., et al., Repeated eccentric contractions positively regulate muscle oxidative metabolism and protein synthesis during cancer cachexia in mice. J Appl Physiol, 2020. Doi: 10.1152/japplphysiol.00908.2019.
17. Ahmadabadi F., et al., The effects of high-intensity interval training and saffron aqueous extract supplementation on alterations of body weight and apoptotic indices in skeletal muscle of 4T1 breast cancer-bearing mice with cachexia. Appl Physiol Nutr Metab., 2020. doi: 10.1139/apnm-2019-0352.
18. Argilés JM., et al., Are there any benefits of exercise training in cancer cachexia?. J Cachexia Sarcopenia Muscle, 2012. doi: 10.1007/s13539-012-0067-5.
19. Lira FS., et al., Effect of endurance training upon lipid metabolism in the liver of cachectic tumour-bearing rats. Cell Biochem Funct, 2008. doi: 10.1002/cbf.1495.
20. Donatto FF., et al., Resistance exercise modulates lipid plasma profile and cytokine content in the adipose tissue of tumour-bearing rats. Cytokine, 2013. doi: 10.1016/j.cyto.2012.10.021
21. Lira FS., et al., Exercise training decreases adipose tissue inflammation in cachectic rats. Horm Metab Res, 2012. doi: 10.1055/s-0031-1299694.
22. Faustino-Rocha AI., et al., Effect of lifelong exercise training on mammary tumorigenesis induced by MNU in female Sprague-Dawley rats. Clin Exp Med., 2016. doi: 10.1007/s10238-016-0419-0
23. Padrao AI., et al., Long-term exercise training prevents mammary tumorigenesis-induced muscle wasting in rats through the regulation of TWEAK signalling. Acta Physiol (Oxf)., 2017. doi: 10.1111/apha.12721.











